Monoamino oxidase
| Monoamino oxidase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Número EC | 1.4.3.4 | ||||||||
| Número CAS | 9001-66-5 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||

| |
| Diagrama de fitas dun monómero da MAO-A humana unida a FAD e clorxilina, orientada como se estivese unida á membrana mitocondrial externa. De PDB 2BXS. | |
| Identificadores | |
| Símbolo | MAOA |
| Entrez | 4128 |
| HUGO | 6833 |
| OMIM | |
| RefSeq | NM_000240 |
| UniProt | P21397 |
| Outros datos | |
| Locus | Cr. X p11.4-p11.3 |
| |
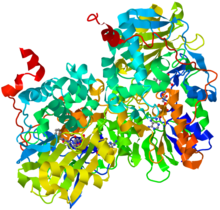
| Diagrama de fitas da MAO-B humana. De PDB 1GOS. | |
| Identificadores | |
| Símbolo | MAOB |
| Entrez | 4129 |
| HUGO | 6834 |
| OMIM | |
| RefSeq | NM_000898 |
| UniProt | P27338 |
| Outros datos | |
| Locus | Cr. X p11.4-p11.3 |
As L-monoamino oxidases ou MAO (EC 1.4.3.4) son un grupo de encimas que catalizan a oxidación de monoaminas.[1][2] Están unidas á membrana externa das mitocondrias da maior parte dos tipos celulares do corpo. O primeiro encima MAO descubriuno Mary Bernheim no fígado humano e foi daquela denominado tiramina oxidase.[3][4] Pertencen á familia proteica das amino oxidorredutases que conteñen flavina.
Subtipos e distribución nos tecidos
[editar | editar a fonte]Nos humanos hai dous tipos de MAO: MAO-A e MAO-B.[5]
- Ambas as dúas encóntranse en neuronas e na astroglía.
- Fóra do sistema nervioso central distribúense así:
- A MAO-A tamén se encontra no fígado, endotelio vascular pulmonar, tracto gastrointestinal, e placenta.
- A MAO-B atópase fundamentalmente nas plaquetas do sangue.
Función
[editar | editar a fonte]
As monoamino oxidases catalizan a desaminación oxidativa de monoaminas. Utilizan o oxíxeno para retirar un grupo amino dunha molécula, orixinando o correspondente aldehido e amoníaco.
As monoamino oxidases conteñen o cofactor FAD unido covalentemente, polo que son unhas oxidases que se clasifican como flavoproteínas.
Especificidades de substrato
[editar | editar a fonte]As MAO son encimas ben coñecidos en farmacoloxía, xa que son o substrato sobre o que actúan os diversos fármacos inhibidores da monoamino oxidase. A MAO-A é especialmente importante no catabolismo das monoaminas inxeridas na dieta. Ambas as MAOs son tamén vitais para a inactivación de neurotransmisores monoaminérxicos, para os cales mostran diferentes especificidades, que son:
- A serotonina, melatonina, norepinefrina, e epinefrina son degradadas principalmente pola MAO-A.
- A fenetilamina e bencilamina son degradadas principalmente pola MAO-B.
- Ambas as formas do encima degradan a dopamina, tiramina, e triptamina.[7]
Reaccións específicas catalizadas pola MAO son:
- Transformación da epinefrina ou a norepinefrina en ácido 3,4-dihidroximandélico.
- Transformación da metanefrina ou a normetanefrina en ácido vanillilmandélico (VMA).
- Transformación da dopamina en ácido dihidroxifenilacético.
- Transformación da 3-metoxitiramina en ácido homovaníllico.
Importancia clínica
[editar | editar a fonte]Debido ao papel fundamental que exercen as MAOs na inactivación de neurotransmisores, a disfunción da MAO (excesiva ou insuficiente actividade da MAO) pénsase que é responsable de varios trastornos neurolóxicos e psiquiátricos. Por exemplo, os niveis infrecuentemente altos ou baixos das MAOs no corpo foron asociados, entre outras cousas, con esquizofrenia,[8][9] ou depresión.[10] Os inhibidores da monoamino oxidase son unha das principais clases de fármacos prescritos para o tratamento da depresión, aínda que xeralmente son un tratamento de última liña, debido ao risco de interacción deste fármaco con produtos da dieta ou outros fármacos. Os niveis excesivos de catecolaminas (epinefrina, norepinefrina, e dopamina) poden orixinar unha crise hipertensiva, e os niveis excesivos de serotonina poden causar a síndrome da serotonina.
Os inhibidores da MAO-A actúan como axentes antidepresivos e ansiolíticos, mentres que os inhibidores da MAO-B utilízanse sós ou en combinación para tratar as enfermidades de Alzheimer e de Parkinson.[11]
As investigacións con tomografía de emisión de positróns descubriron que a MAO-B tamén diminúe moito ao fumar cigarros de tabaco.[12]
Modelos animais
[editar | editar a fonte]Os ratos que non teñen a capacidade de producir MAO-A ou MAO-B presentan trazos similares aos do autismo.[13] Estes ratos knockout mostran unha resposta ao estrés incrementada.[14]
Xenética
[editar | editar a fonte]Os xenes que codifican a MAO-A e a MAO-B están localizados un ao lado do outro no brazo curto do cromosoma X, e teñen un 70% de semellanza de secuencia. Existen raras mutacións nestes xenes asociadas coa síndrome de Brunner.
Un estudo baseado na cohorte Dunedin (unha poboación estudada de Dunedin, Nova Zelandia) chegou á conclusión de que os nenos maltratados cun polimorfismo de baixa actividade na rexión do promotor do xene da MAO-A eran máis propensos a desenvolver un trastorno de conduta antisocial que os nenos maltratados coa variante de alta actividade.[15] Dos 442 individuos (machos) estudados (maltratados ou non), o 37% tiña a variante de baixa actividade. Dos 13 individuos maltratrados con baixa actividade de MAO-A, 11 foron examinados e mostraban trastornos de conduta adolescente e 4 foron condenados nos tribunais por delitos violentos. O mecanismo suxerido deste efecto é a diminución da capacidade dos que teñen baixa actividade de MAO-A para degradar rapidamente a norepinefrina, o neurotransmisor sináptico implicado na excitación simpática e ira. Considérase que isto proporciona un apoio directo para a idea de que a susceptibilidade xenética ás doenzas non está determinada de nacemento, senón que varía coa exposición a influencias ambientais. Porén, a maioría dos individuos con trastornos de conduta ou con condenas non tiñan actividade baixa da MAO-A; atopouse que o maltrato causaba unha maior predisposición ao comportamento antisocial que as diferenzas na actividade de MAO-A.
A afirmación de que a interacción da baixa actividade de MAO-A e o maltrato causa un comportamento antisocial foi criticada, xa que a predisposición cara ao comportamento antisocial podería perfectamente ser causada por outros xenes herdados de parentes maltratadores.[16]
Atopouse unha posible ligazón entre a predisposición á busca de novidades e un xenotipo do xene da MAO-A.[17]
Unha variante particular (ou xenotipo), denominado na prensa popular "xene guerreiro", está sobrerrepresentado no pobo maorí. Isto apoia estudos anteriores que encontraron diferentes proporcións de variantes en diferentes grupos étnicos. Isto é o caso de moitas variantes xenéticas, cun 33% de brancos/non hispanos, e 61% de asiáticos/illeiros do Pacífico que tiñan unha baixa actividade da variante do promotor de MAO-A.[18]
Notas
[editar | editar a fonte]- ↑ Tipton KF, Boyce S, O'Sullivan J, Davey GP, Healy J (Aug 2004). "Monoamine oxidases: certainties and uncertainties". Current Medicinal Chemistry 11 (15): 1965–82. PMID 15279561. doi:10.2174/0929867043364810.
- ↑ Edmondson DE, Mattevi A, Binda C, Li M, Hubálek F (Aug 2004). "Structure and mechanism of monoamine oxidase". Current Medicinal Chemistry 11 (15): 1983–93. PMID 15279562. doi:10.2174/0929867043364784.
- ↑ Hare ML (1928). "Tyramine oxidase: A new enzyme system in liver". The Biochemical Journal 22 (4): 968–79. PMC 1252213. PMID 16744124. doi:10.1042/bj0220968.
- ↑ Slotkin TA (1999). "Mary Bernheim and the discovery of monoamine oxidase". Brain Research Bulletin 50 (5-6): 373. PMID 10643441. doi:10.1016/S0361-9230(99)00110-0.
- ↑ Shih JC, Chen K (Aug 2004). "Regulation of MAO-A and MAO-B gene expression". Current Medicinal Chemistry 11 (15): 1995–2005. PMID 15279563. doi:10.2174/0929867043364757.
- ↑ Figure 11-4 in: Flower R, Rang HP, Dale MM, Ritter JM (2007). Rang & Dale's pharmacology. Edinburgh: Churchill Livingstone. ISBN 0-443-06911-5.
- ↑ Kalgutkar AS, Dalvie DK, Castagnoli N, Taylor TJ (Sep 2001). "Interactions of nitrogen-containing xenobiotics with monoamine oxidase (MAO) isozymes A and B: SAR studies on MAO substrates and inhibitors". Chemical Research in Toxicology 14 (9): 1139–62. PMID 11559028. doi:10.1021/tx010073b.
- ↑ Domino EF, Khanna SS (Mar 1976). "Decreased blood platelet MAO activity in unmedicated chronic schizophrenic patients". The American Journal of Psychiatry 133 (3): 323–6. PMID 943955. doi:10.1176/ajp.133.3.323.
- ↑ Schildkraut JJ, Herzog JM, Orsulak PJ, Edelman SE, Shein HM, Frazier SH (Apr 1976). "Reduced platelet monoamine oxidase activity in a subgroup of schizophrenic patients". The American Journal of Psychiatry 133 (4): 438–40. PMID 1267046. doi:10.1176/ajp.133.4.438.
- ↑ Meyer JH, Ginovart N, Boovariwala A, Sagrati S, Hussey D, Garcia A, Young T, Praschak-Rieder N, Wilson AA, Houle S (Nov 2006). "Elevated monoamine oxidase a levels in the brain: an explanation for the monoamine imbalance of major depression". Archives of General Psychiatry 63 (11): 1209–16. PMID 17088501. doi:10.1001/archpsyc.63.11.1209.
- ↑ Riederer P, Lachenmayer L, Laux G (Aug 2004). "Clinical applications of MAO-inhibitors". Current Medicinal Chemistry 11 (15): 2033–43. PMID 15279566. doi:10.2174/0929867043364775.
- ↑ Fowler JS, Volkow ND, Wang GJ, Pappas N, Logan J, MacGregor R, Alexoff D, Wolf AP, Warner D, Cilento R, Zezulkova I (1998). "Neuropharmacological actions of cigarette smoke: brain monoamine oxidase B (MAO B) inhibition". Journal of Addictive Diseases 17 (1): 23–34. PMID 9549600. doi:10.1300/J069v17n01_03.
- ↑ Bortolato M, Godar SC, Alzghoul L, Zhang J, Darling RD, Simpson KL, Bini V, Chen K, Wellman CL, Lin RC, Shih JC (May 2013). "Monoamine oxidase A and A/B knockout mice display autistic-like features". The International Journal of Neuropsychopharmacology / Official Scientific Journal of the Collegium Internationale Neuropsychopharmacologicum 16 (4): 869–88. PMC 3517692. PMID 22850464. doi:10.1017/S1461145712000715.
- ↑ Shih JC (Jan 2004). "Cloning, after cloning, knock-out mice, and physiological functions of MAO A and B". Neurotoxicology 25 (1-2): 21–30. PMID 14697877. doi:10.1016/s0161-813x(03)00112-8.
- ↑ Caspi A, McClay J, Moffitt TE, Mill J, Martin J, Craig IW, Taylor A, Poulton R (Aug 2002). "Role of genotype in the cycle of violence in maltreated children". Science 297 (5582): 851–4. PMID 12161658. doi:10.1126/science.1072290.
- ↑ Sesardic N (2005). Making sense of heritability. Cambridge, UK: Cambridge University Press. ISBN 0-521-82818-X.
- ↑ Shiraishi H, Suzuki A, Fukasawa T, Aoshima T, Ujiie Y, Ishii G, Otani K (Apr 2006). "Monoamine oxidase A gene promoter polymorphism affects novelty seeking and reward dependence in healthy study participants". Psychiatric Genetics 16 (2): 55–8. PMID 16538181. doi:10.1097/01.ypg.0000199447.62044.ef. Resumo divulgativo – medialifemagazine.com.
- ↑ Sabol SZ, Hu S, Hamer D (Sep 1998). "A functional polymorphism in the monoamine oxidase A gene promoter". Human Genetics 103 (3): 273–9. PMID 9799080. doi:10.1007/s004390050816.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Estrutura da MAO-B en eurekalert.org
- Orientacións calculadas da monoaminooxidase na membrana
- Monoamino oxidase (MAO) en bmc.uu.se
- Diapositivas que mostran os efectos de fumar tabaco sobre a MAO en nida.nih.gov Arquivado 02 de xaneiro de 2010 en Wayback Machine.
- Alimentos a evitar cando se toman inhibidores da MAO en lycaeum.org
- Information Hyperlinked Over Proteins -- MAO-A
